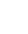心肌肥厚和心力衰竭模型
四川格林泰科拥有经验丰富的技术团队和成熟的技术平台,能为客户提供心肌肥厚和心力衰竭动物模型构建及体内药理学和药效学研究服务,适用于国内外IND申报。
心力衰竭和心肌肥厚发病机理
心力衰竭(Heart failure,HF)是由于心脏结构或功能性疾病导致心室充盈或射血能力受损的一组复杂临床综合征,发病率高,是各种心血管病发生发展的共同结局,主要临床表现为呼吸困难、乏力,以及肺瘀血和外周水肿。当心脏面临高血压、主动脉狭窄、肺动脉高压等导致左、右心室压力负荷(后负荷)过重的情况时,心室肌代偿性肥厚以保证射血量维持正常水平,但持久的负荷过重会导致心肌结构和功能进一步改变而失代偿。
可提供的心肌肥厚和心力衰竭模型
1、心肌缺血性心衰模型
模型 | 动物种属 | 诱导方式 | 病理特征 | 运用领域 |
冠状动脉栓塞法 (DSA介入) | 猪、犬、非人灵长类 | 采用导管介入技术,将栓塞物质注入冠脉血管。 | 能够产生不可逆的包括左室功能不全、射血分数下降和神经内分泌激活等心衰症状。 | 适用于研究心肌缺血和梗死后左室重构。 |
冠状动脉结扎法 | 大鼠、猪、犬、非人灵长类 | 结扎左冠状动脉主干或左前降支、左旋支以及对角支。 | 可以有效复制梗死后心衰急性期、代偿期两个阶段。 | 主要用于研究心肌梗死与心肌肥厚过渡到心衰过程中细胞和亚细胞改变机制。 |
2、压力负荷过载型心衰模型:TAC模型、AAC模型
压力负荷过载使心脏收缩耗氧量增加、心肌代谢紊乱、肾素-血管紧张素-醛固酮系统活跃、左心室重构,最终发展为心衰。适合研究舒张功能障碍以及左室代偿性肥厚导致心衰进程中心肌病理变化和分子机制。
诱导方式:主动脉弓缩窄(TAC)或腹主动脉缩窄(AAC)
动物种属:大鼠、小鼠
病理特征:主动脉压升高,左室压力负荷过载,可以模拟后负荷增高导致心脏肥厚(4周左右)直至心力衰竭(12周左右)的病理过程
3、药源性心衰模型
采用阿霉素、儿茶酚胺等有心脏毒性的药物来损伤或降低心肌收缩能力,改变神经内分泌激活系统,显著降低射血分数,引起心室功能不全,从而导致心衰。常用来建立慢性动物心衰模型,研究心肌病及心衰的发病机制以及评估新的治疗措施。
诱导方式:阿霉素尾静脉注射
动物种属:大鼠
病理特征:局灶性心肌细胞变性、水肿、空泡形成及心肌间质纤维化,提示发生左室重构和心肌纤维化。
4、快速起搏型心衰模型
与人类心衰血流动力学和神经内分泌变化相似。可通过改变起搏频率和起搏持续时间,复制出不同程度心功能损伤,可以用来研究慢性心衰不同阶段的病理生理改变、分子生物学特征、神经内分泌变化以及药物干预。
诱导方式: 心外膜快速起搏右心室
动物种属:犬
病理特征:双心室进行性扩张,同时伴随舒张功能不全,射血分数和心输出量显著下降,外周血管阻力增加等。
5、容量负荷过载型心衰模型
容量负荷(前负荷)过载可以引起心室扩张、包括肾素-血管紧张素系统在内的神经内分泌系统的激活、心肌代偿性肥厚,继而发展为心衰。
诱导方式:容量负荷过载型心衰模型包括动静脉瘘、主动脉瓣关闭不全、二尖瓣破损等诱导方法,可根据客户需求定制。
动物种属:猪、犬、非人灵长类等。
模型评价主要指标
- 超声心动图:左室舒张期内径(LVEDD)、左室收缩期内径(LVESD)、左室舒张末容量(LVEDV)、左室收缩末容量(LVESV)、左室后壁厚度(LPwT)、射血分数(EF)、心输出量(CO)、FS、SV、各心腔的腔径、厚度、E/A比值、肺动脉压力等
- 有创血流动力学检查:中心静脉压(CVP)、右房压(RAP)、右室压(RVP)、肺动脉压(PAP)和肺毛细血管楔压(PCWP)、心输出量(CO)
- 12导联心电图
- 心肌酶谱及生化检查
- 组织病理学
基本服务
- 体重,食物摄入,排泄
- 血液采集和组织采集
可选服务
- MRI等影像学检测
- 冠脉造影(适用于大动物)
经典案例
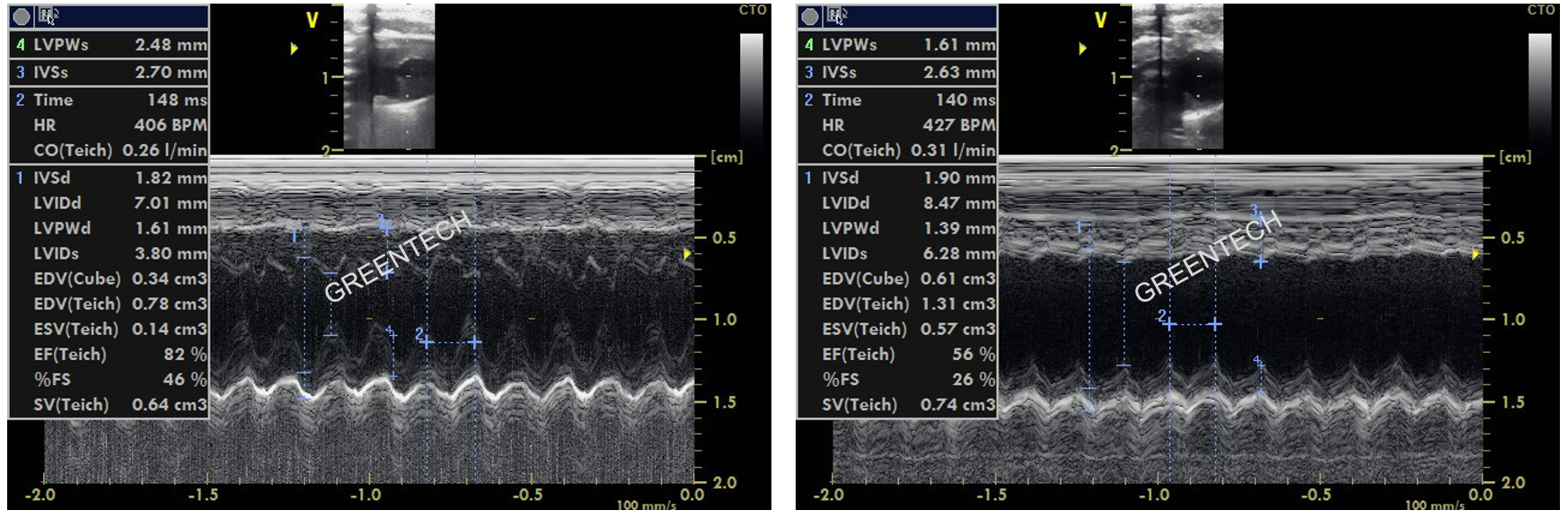
图1. SD大鼠行心脏冠脉结扎(LAD)术前及术后一周超声心动图
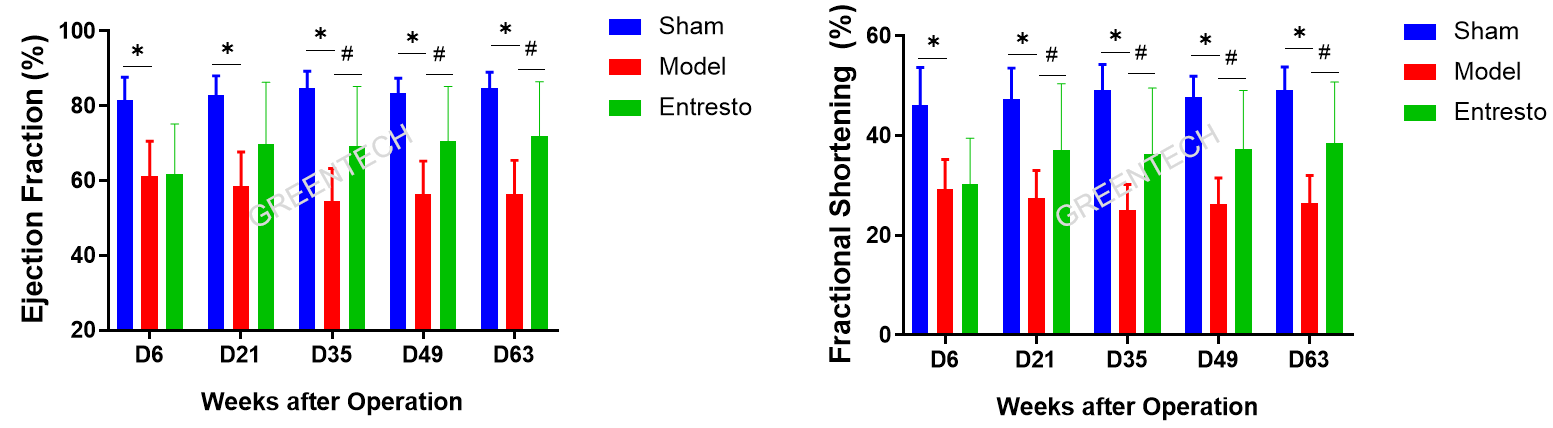
图2. SD大鼠行心脏冠脉结扎(LAD)术后进行治疗,不同时间点进行心功能指标
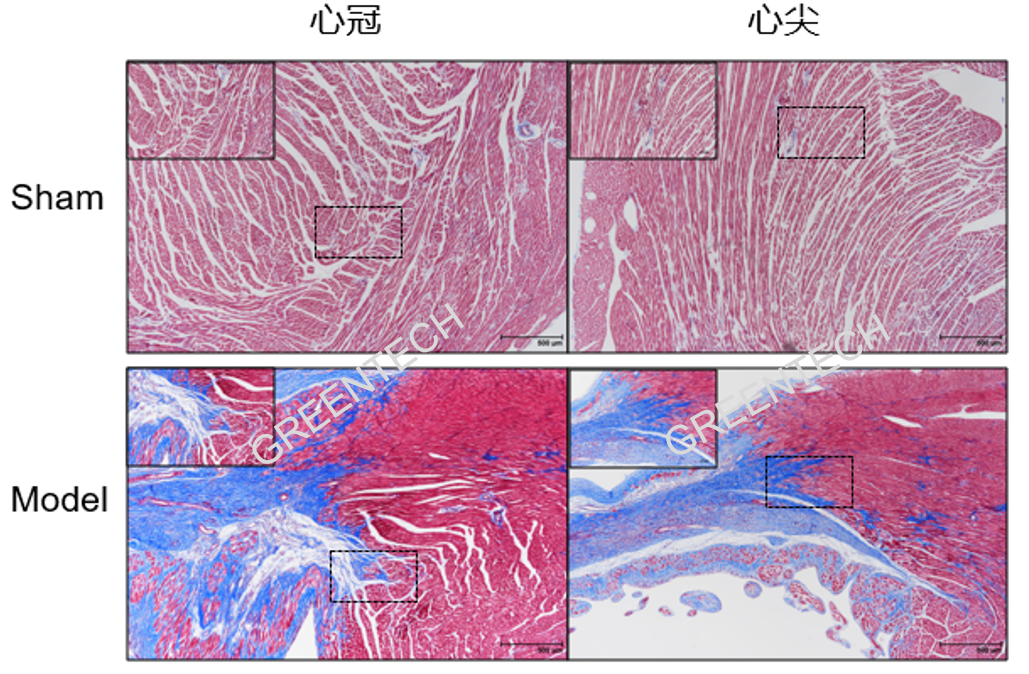
图3、LAD结扎诱导心肌梗塞大鼠模型(Masson染色)。正常对照组:大鼠心脏组织仅血管附近少量胶原沉积,胶原染色极少;模型组大鼠:心脏组织纤维化明显,梗死区域大量胶原纤维蓄积。
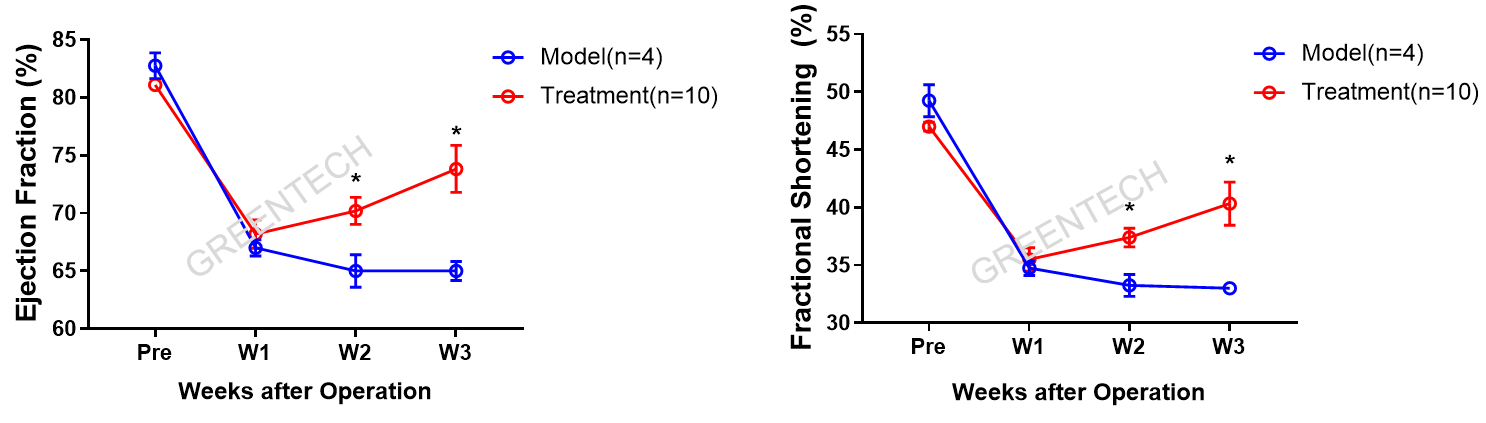
图4. 恒河猴行心脏冠脉结扎(LAD)术后进行治疗,不同时间点进行超声心动图检测心功能
欢迎联系我们,共同探讨您的心肌肥厚和心力衰竭新药研发项目,体验我们的服务。
参考文献
1. 徐创业,等: 大动物心衰模型研究进展 北京生物医学工程 第32卷第5期 2013年10月
2. Conceição, G., Heinonen, I., Lourenço, A. P., Duncker, D. J., & Falcão-Pires, I. (2016). Animal models of heart failure with preserved ejection fraction. Netherlands Heart Journal, 24(4), 275–286. doi:10.1007/s12471-016-0815-9
3. Janssen, P. M. L., & Elnakish, M. T. (2019). Modeling heart failure in animal models for novel drug discovery and development. Expert Opinion on Drug Discovery, 1–9.